طلا شکلپذیرترین فلز است. یک گرم از این عنصر را میتوان آن قدر چکش زد تا به اندازهٔ یک ورق با مساحت یک متر مربع پهن شود یا یک اونس را به اندازهٔ ۳۰۰ پا پهن کرد.[۸] برگهٔ طلا میتواند آن قدر نازک شود تا در پایان شفاف شود در این صورت نور گذرا از آن به رنگ آبی مایل به سبز خواهد بود چون طلا به شدت نور زرد و قرمز را باز میتاباند.[۹] چنین ورقههای نیمه شفافی به خوبی پرتوهای فروسرخ را باز میتابانند. این ویژگی در پوششهای محافظ در برابر پرتوهای فروسرخ یا پرتوهای گرمایی مانند لباسهای محافظ در برابر گرما یا در برابر خورشید مانند لباس فضانوردان به کار میآید.[۱۰]
طلا میتواند با بسیاری از فلزها آلیاژ شود. این آلیاژها در بهدست آوردن سختی و نرمیهای گوناگون، دمای ذوب مناسب، پدیدآوردن رنگ دلخواه و دیگر کاربردهای فلزشناسی مورد نیازند.[۱۱] طلا رسانای خوب گرما و جریان برق است. از نظر شیمیایی رطوبت هوا و واکنشگرهای خورنده بر آن بیاثرند. به همین دلیل در ساخت سکه و گوهرسازی بسیار مناسب است و البته میتوانند پوششی مناسب برای دیگر فلزهای واکنشپذیر باشد. طلا دارای میل ترکیبی بسیار پایینی است و در برابر بیشتر اسید و بازها ایستادگی میکند. میتوان گفت طلا عنصری حل نشدنی است هرچند که در تیزاب سلطانی میتوان آن را حل کرد.
اکسیدهای معمول طلا عبارتند از طلای یک و سه بار مثبت یا طلا(I) و طلا(III). یونهای طلا در محلول به آسانی کاهیده میشوند در صورت افزودن هر فلز دیگری در نقش عامل کاهش، میبینیم که فلز افزوده اکسید و حل میشود در مقابل فلز جامد طلا در ظرف تهنشین میشود.
طلای پالودهٔ باکیفیت، بیبو، بیمزه و پایدار در برابر خوردگی است.[۱۲] طلا چگالی بالایی دارد، یک مترمکعب از آن ۱۹٬۳۰۰ kg جرم دارد. برای مقایسه: چگالی سرب 11,340 kg/m۳ و چگالی سنگینترین عنصر یعنی اسمیم 22,610 kg/m۳ است.
رنگ[ویرایش]
همچنین ببینید: شیمی کوانتومی نسبیتی
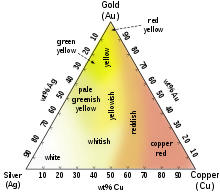
رنگهای گوناگون آلیاژهای Ag-Au-Cu
در حالی که بیشتر فلزهای پالوده (خالص) به رنگ خاکستری، نقرهای یا سفید اند، طلا به رنگ زرد است. این رنگ نشان میدهد که چه میزان الکترونهای تراز والانسی آزادند و در شمار انبوه به این سو و آن سو میروند (پلاسمون). بسامد این جابجاییها در بیشتر فلزها در بازهٔ فرابنفش است اما برای طلا در بازهٔ نور دیدنی (مرئی) میافتد. این به دلیل اثرهای نسبیتی-کوانتومی در ابر الکترونی پیرامون اتم طلا است.[۱۳][۱۴]
ضریب بازتاب آینههای ساختهشده از آلومینیوم (Al)، نقره (Ag) و طلا (Au)
رنگ پیشبینی شده توسط مدل کوانتومی (غیرنسبیتی) برای طلا سفید و همانند نقره است، اما وارد کردن اثرات اختلالی نسبیتی میتواند رنگ زرد خاص فلز طلا بر خلاف رنگ سفید یا نقرهای بیشتر فلزات دیگر را توجیه کند. همانطور که در شکل دیده میشود، طیف نور بازتابشده از فلزاتی نظیر نقره (Ag) یا آلومینیوم (Al) در بازهٔ طول موج نور مرئی (۴۰۰ تا ۸۰۰ نانومتر) ثابت بوده و این فلزات همهٔ رنگها را با شدت یکسان بازتاب میکنند و بنابراین سفید دیده میشوند. اما طلا، نور آبی (طول موجهای حدود ۴۰۰ نانومتر) را بیشتر از بقیه رنگها جذب کرده و در نتیجه زرد رنگ دیده میشود.
گذار اتمی متناظر به این جذب، گذار 5d-6s است. در اتمهای نقره (Z=۴۷) و آلومینیوم (Z=۱۳) اثرات نسبیتی وجود دارند اما آنقدر قوی نیستند تا با افزایش فاصلهٔ انرژی دو اربیتال 6s و 5d، اینگذار را به طول موجها مرئی منتقل کنند. اما در طلا (Z=۷۹)، اینگذار در حوالی نور آبی اتفاق افتاده و رنگ ویژهٔ زرد رنگ طلا را ایجاد میکند.[۱۵]
آلیاژهای رنگی طلا مانند طلای قرمز را میتوان با افزودن اندکی مس و نقره بدست آورد. مثلث کناری رنگهای گوناگون آلیاژهای نقره-طلا-مس را نشان میدهد. آلیاژهای دیگر طلا مانند نیکل و پالادیم هم در گوهرسازی تجاری مهم اند چون با کمک آنها به آلیاژ طلای سفید دست مییابیم. افزودنیهای دیگر مانند منگنز، آلومینیم، آهن، ایندیم و… میتوانند رنگهای دیگری از طلا بدست آوردند که چندان معمول نیست و کاربردهای دیگری دارد.[۱۱]
طلای سبز: در صورت ترکیب فلز طلا با فلز روی، رنگ طلا به سمت رنگ سبز میل میکند و هرچه درصد فلز روی بالاتر رود میزان سبزی هم بیشتر میشود.
طلای بنفش: از ترکیب فلزهای طلا و آلومینیوم با نسبت یک اتم طلا در مقابل دو اتم آلومینیوم فلزی با رنگ جذاب ارغوانی ایجاد خواهد شد. در واقع ۷۹ درصد ترکیب فوق طلا است که ۱۸ عیار ارزیابی میشود.[۱۶]
ایزوتوپها[ویرایش]
مقالهٔ اصلی: ایزوتوپهای طلا
تنها ایزوتوپ پایدار و طبیعی طلا ۱۹۷Au است. طلا دارای ۳۶ ایزوتوپ پرتوزا است که همگی به صورت آزمایشگاهی پدید میآیند و در بازهٔ جرم اتمی ۱۶۹ تا ۲۰۵ جای دارند. پایدارترین آنها ۱۹۵Au است که نیمهعمر ۱۸۶٫۱ روزی دارد. ناپایدارترین آنها نیز ۱۷۱Au است که نشر پروتون دارد و نیمهعمرش ۳۰ µs است. بیشتر ایزوتوپهای پرتوزای طلا که جرم اتمی زیر ۱۹۷ دارند در اثر واپاشی آلفا، واپاشی بتا و نشر پروتون از میان میروند. ۱۹۵Au که با جذب الکترون از میان میرود و ۱۹۶Au که بیشتر با جذب الکترون (۹۳٪) و کمتر با واپاشی β- از میان میرود (۷٪)،[۱۷] تنها استثناهای این پدیدهاند. همهٔ ایزوتوپهای پرتوزای طلا با جرم اتمی بالاتر از ۱۹۷ با واپاشی β- از میان میروند.[۱۸]
دست کم ۳۲ هستهٔ همپار شناخته شدهاست که جرم اتمی در بازهٔ ۱۷۰ تا ۲۰۰ داشتهاند. در میان این بازه تنها ۱۷۸Au, ۱۸۰Au, ۱۸۱Au, ۱۸۲Au, and ۱۸۸Au همپار ندارند. پایدارترین همپار طلا ۱۹۸m2Au با نیمه عمر ۲٫۲۷ روز و ناپایدارترین ۱۷۷m2Au با نیمه عمر ۷ ns است. ۱۸۴m1Au با سه واپاشی β+، گذار ایزومری (تابش گاما) و واپاشی آلفا رو به نابودی میگذارد. هیچکدام دیگر از همپار یا ایزوتوپهای طلا از سه راه واپاشی نابود نمیشوند.[۱۸]